近日發表于Diabetes Care雜志的一項為期26周的隨機化、多中心、雙盲臨床試驗結果結果顯示,每天一次的司美魯肽(Semaglutide)以0.3mg/d的劑量對2型糖尿病患者的降糖效果顯著優于利拉魯肽與安慰劑對照,但其消化道不良事件的發生率亦高于后兩者。
司美魯肽是FDA于去年5月批準的一種新型GLP-1受體激動劑類降糖藥,通過乙酰化實現了可以每周給藥一次的長效性,因此與利拉魯肽等每天一次的GLP-1受體激動劑相比具有一定的優勢,又因為其顯著的降糖與減重效果而被譽為“史上最好的降糖藥”。此外,原研方諾和諾德也在積極推進口服司美魯肽的臨床開發,將會使司美魯肽的市場表現錦上添花。
本文以FDA橙皮書、Thomson Reuters Integrity報告為基礎,再結合主自的專利檢索,分析了司美魯肽原研方的專利布局,從而為國內志在仿制司美魯肽的企業提供專利風險分析的基礎資料。
已上市產品的專利
(一)化合物專利
FDA橙皮書中的US8129343與US8536122同為司美魯肽的基礎化合物專利,其中國同族專利CN200680006674.6已授權,有效期截至2026年3月19日。中國化合物專利在其授權公告文本的權利要求1就保護了司美魯肽的結構。雖然有兩件中國化合物專利的分案申請(CN201310534370.9與CN201410513914.8),但均未授權,且已中上了審查進程。
(二)組合物/制劑專利
根據FDA公布的產品說明書,司美魯肽注射液中含有丙二醇作為其輔料之一。FDA橙皮書中的US8114833保護了含有丙二醇的肽制劑,其中國同族專利CN200480034152.8已授權,有效期截至2024年11月17日。值得注意的是,諾和諾德的另一款GLP-1受體激動劑利拉魯肽的制劑中也含有丙二醇作為其輔料之一,所以US8114833也是FDA橙皮書中收錄的利拉魯肽專利之一。
(三)給藥裝置專利
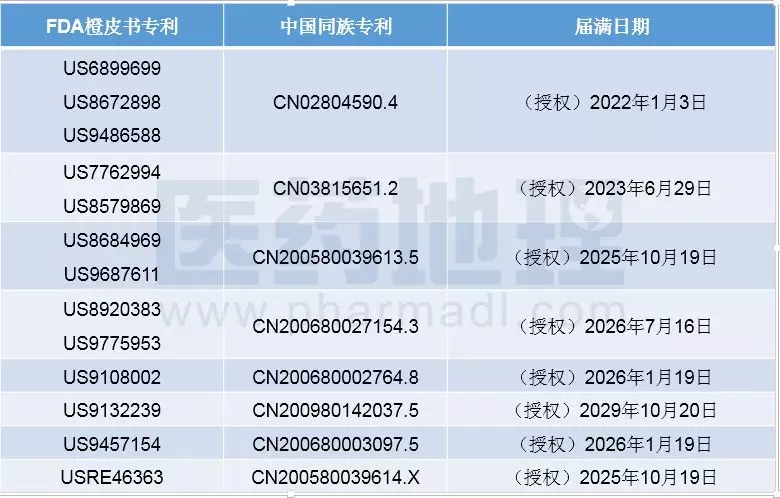
FDA橙皮書中收錄的司美魯肽的其他專利均為與其給藥裝置相關的專利,如下表所示。
表1 FDA橙皮書中收錄的與司美魯肽給藥裝置相關的專利
 其他產品專利
其他產品專利
(一)口服制劑專利
諾和諾德公司于2011年12月16日要求的中國專利CN201180060463.1于其公開文本的權利要求1要求保護“包含GLP-1激動劑和N-(8-(2-羥基苯甲酰)氨基)辛酸鹽(SNAC)的用于口服給藥的固體組合物”,并于權利要求11將所述的GLP-1激動劑限定為司美魯肽。但由于C Beglinger等人在Pharmacokinetics and Pharmacodynamic Effects of Oral GLP‐1 and
PYY3‐36: A Proof‐of‐concept Study in Healthy Subjects.(Clinical Pharmacology and Therapeutics, 2008, 84(4):468~474) 一文中已經公布了采用SNAC實現GLP-1受體激動劑口服給藥的技術方案,而且技術問題以及技術效果均與CN201180060463.1相同,因此,審員以最終以不滿足創造性要求為理由駁回了該專利申請。雖然諾和諾德公司提出了復審請求,并申請了分案,但個人覺得挽回的余地不大。
雖然CN201180060463.1及其分案的授權前景不容樂觀,但諾和諾德申請了一系列外圍專利,并取得了很好的補救效果。
2013年3月15日申請的CN2013800115554.2已獲得授權,該專利對包含司美魯肽與SNAC的口服藥物組合物進行了改良,具體的,公告文本的權利要求1保護的技術方案如下所示:包含第一類型顆粒和第二類型顆粒的藥物組合物,其中所述第一類型顆粒包含SNAC且不含GLP?1肽,且其中所述第二類型顆粒包含GLP?1肽且不含SNAC,所述SNAC的釋放與所述GLP?1肽的釋放同時發生,或者所述SNAC的釋放比所述GLP?1肽的釋放更快,所述釋放是通過使用基于美國藥典35的測定(I)的溶出度試驗在30分鐘內、pH值1?6.8的任一pH下進行確定的。
優先權日期為2013年5月2日的WO2014177683于其權利要求1中要求保護“包含GLP-1肽與增強子的口服固體組合物”,并于權利要求5、6將所述的增強子限定為SNAC,于權利要求8將所述的GLP-1肽限定為司美魯肽,但該專利未進入中國。
2013年10月16日申請的CN201380054130.7于其公開說明書的權利要求1要求保護“包含GLP-1肽和至少一種脂肪酸氨基酸藥物組合物”,并于權利要求2將藥物組合物限定為口服藥物組合物,但該專利已被視為撤回。
諾和諾德于2016年1月28日申請了CN201680007764.0,該專利尚處于實質審查階段,其公開文本的權利要求1要求保護“固體藥物組合物,其包含ⅰ)包含中鏈脂肪酸的鹽和GLP-1激動劑的芯;和ⅱ)在pH6.0或更高,如PH6.5或更高,或pH7.0或更高時溶解的第一包衣”。
(二)其他產品專利
優先權日期為2016年12月16日WO2018109162要求保護一種含有胰島素的藥物組合物,并在權利要求13將所述藥物組合物限定為“可進一步包含司美魯肽”。
用途專利
優先權日期為2012年7月1日的WO2014005858要求保護采用長效GLP-1受體激動劑治療2型糖尿病與肥胖癥等疾病的方法,但該專利未進入中國。
優先權日期為2016年4月28日的WO2017186896要求保護“采用司美魯肽治療并發有心血管疾病的2型糖尿病患者的方法”,該專利尚未進入中國。
總結
司美魯肽是繼續艾塞那肽、利拉魯肽、阿比魯肽、度拉魯肽與利西拉肽之后上市的第六個GLP-1受體激動劑類降糖藥,因為良好的降糖與減重效果,以及每周一次的給藥方案而備受青睞。而正在處于研發階段的口服制劑如果成功上市,也將開創GLP-1受體激動劑口服給藥的先河。而隨著利拉魯肽的專利到期,諾和諾德公司對司美魯肽給予了很高的期望,自然會對其進行周密的專利布局。
根據本文的分析結果,諾和諾德公司的司美魯肽專利布局覆蓋了化合物、已上市制劑、在研的口服制劑、給藥裝置、用途等諸多方面,為仿制藥廠家的進入構筑了有效的專利壁壘。但由于筆者精力的限制,特別是早期專利對所保護成分描述的多樣性,本文的專利檢索肯定會有所遺漏,還請廣大讀者諒解并補正。


